ראשית המילניום רעש עולם המחקר עם חתימתו של אחד הפרויקטים המהפכניים והחשובים שהוליד המדע המודרני: ריצוף הגנום האנושי. מולקולת הפלא, על שלושת מיליארדי האותיות ולמעלה מ־20 אלף הגנים, מופתה עד תום. האטלס החדש פענח את סדר צמדי האותיות המרכיבים את הדי־אן־איי האנושי, ומיפה את הגנים גם פיזית וגם פונקציונאלית. מדענים בכל העולם קיבלו לידיהם מאגר ידע ענק וסט כלים חדשים, שהלכו והשתכללו עם התקדמות התהליך.
פרופ' ברט ווגלשטיין, מבכירי חוקרי הסרטן בעולם, ישב באותם ימים במעבדתו באוניברסיטת ג'ונס הופקינס שבבולטימור, וידע מה צריך להיות השלב הבא. כמי שהראה לעולם שסרטן היא מחלה גנטית – כלומר, מתפתחת בעקבות מוטציות שמתרחשות בגנים – הבין ווגלשטיין שעכשיו הגיע תורו של פרויקט "הגנום הסרטני": מיפוי מסודר של האונקו־גנים, אותם גנים שתקלות שמתרחשות בהם הופכות את התא לסרטני.
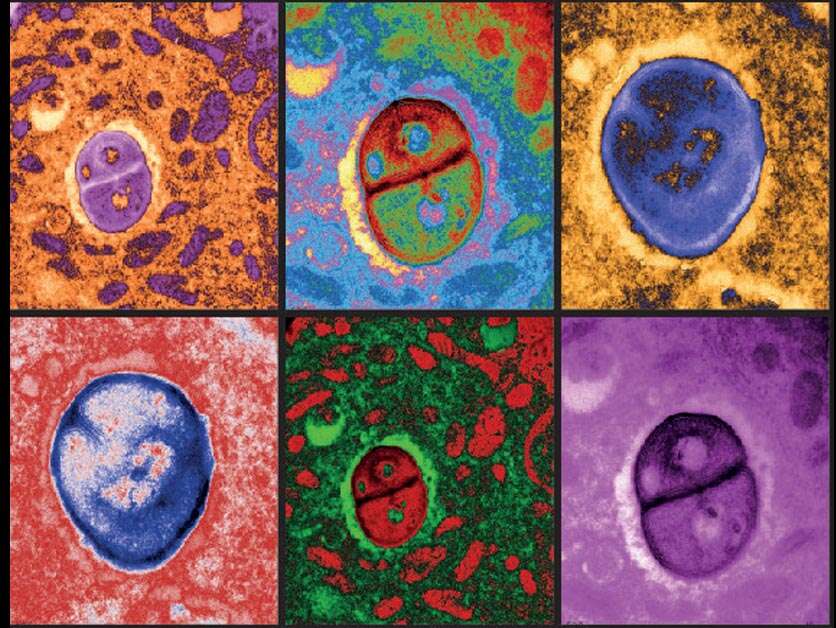 https://www.makorrishon.co.il/wp-content/uploads/2021/05/חיידקים-המתארחים-בתאי-מלנומה-תחת-מיקרוסקופ-אלקטרונים-750x563.jpg 750w" sizes="(max-width: 836px) 100vw, 836px" />
https://www.makorrishon.co.il/wp-content/uploads/2021/05/חיידקים-המתארחים-בתאי-מלנומה-תחת-מיקרוסקופ-אלקטרונים-750x563.jpg 750w" sizes="(max-width: 836px) 100vw, 836px" />כבר בסוף שנות השבעים התחילו בעולם המחקר לדבר על גנים כאלה. אחד המוכרים שבהם הוא p53, שגילויו משמש תעודת כבוד למחקר הישראלי. "שומר הגנום", מכונה הגן הזה: ברגע שהוא מזהה תהליך פגום בתא הוא דואג לתקן אותו, ואם זה לא עובד – הוא מורה על השמדת התא. ברגע שהגן עצמו נפגע, הוא לא יכול למלא את תפקידו נאמנה ולמנוע התפתחות סרטן, ואכן בחלק גדול מאוד מהגידולים הסרטניים ניכרת פגיעה ב־p53. בחלוף השנים למד המדע לזהות גנים נוספים המעורבים בתהליכים סרטניים, אבל ווגלשטיין רצה ליצור אטלס מסודר וסיסטמטי, בדיוק כמו שנעשה עם הגנום האנושי ה"נורמלי". פרויקט כזה, האמין, ייתן תמונה טובה יותר על היווצרות המחלה, יאפשר לבנות כלים ממוקדים יותר לאבחון שלה, ויסייע לפתח שיטות חדשות כדי לרפא אותה.
וכך, בשנת 2003, בחר לעצמו כל אחד מחוקרי המעבדה של ווגלשטיין כמות נאה של גנים לעבוד עליה במסגרת הפרויקט השאפתני. כמה חודשים קודם לכן הצטרפה למעבדה חוקרת ישראלית בשם ירדנה סמואלס. באמתחתה כבר היה דוקטורט מהאימפריאל קולג' בלונדון, שבמסגרתו עסקה במשפחת גנים שאחראים על פעילותו של p53, ועכשיו החליטה לקחת על עצמה קבוצה קטנה של גנים. "זו הייתה משפחה של 16 גנים בסך הכול", משחזרת פרופ' סמואלס. "חברי המעבדה האחרים עבדו על קבוצות גדולות של מאות גנים, אבל אני רציתי לחוש קודם את הפרויקט, להתמקד בקבוצה קטנה שנראה שיש לה קשר לסרטן. עבדתי 'על עיוור', לקחתי גנים שלא ידעתי את שמם ורק סומנו במספרים סידוריים מ־1 עד 16.
"עבדתי 'על עיוור', לקחתי גנים שלא ידעתי את שמם ורק סומנו במספרים מ־1 עד 16. שמתי לב שבדגימות של שני חולי סרטן שונים, ישנה מוטציה זהה באותו גן. זה היה יום ראשון בשבוע, ולא היה אף אחד במעבדה. ניגשתי למשרד של פרופ' ברט ווגלשטיין וסיפרתי לו מה מצאתי. הוא מיד אמר 'יש לך הום ראן'"
"במהלך העבודה שמתי לב שבדגימות די־אן־איי של שני חולי סרטן שונים, ישנה מוטציה זהה באותו גן. זה היה יום ראשון בשבוע, ולא היה אף אחד במעבדה. ניגשתי למשרד של ברט ואמרתי לו: 'שמע, נראה לי שמצאתי משהו מעניין'. סיפרתי לו על המוטציה הזהה, והוא מיד אמר 'יש לך הום ראן'. השפה האמריקנית שלי עדיין לא הייתה מפותחת במיוחד, בטח לא ברמה של היכרות עם טרמינולוגיה של בייסבול, אבל הבנתי שקרה כאן משהו טוב. בדיעבד התברר שזה היה ממש כמו לזכות בלוטו: מצאתי את אחד הגנים הכי חשובים בהתפתחות סרטן".
הגן שבו גילתה סמואלס את המוטציה נקרא PIK3CA. בהמשך התברר כי המוטציה שכיחה בשיעור של כארבעים אחוזים מהחולים בסוגי סרטן מסוימים כמו המעי, הקיבה, השד, המוח והריאות. כבר למחרת שיחתם עדכן ווגלשטיין את כל חוקרי המעבדה בדבר התגלית הסנסציונית, והחל לדחוף את הפרויקט קדימה. שמה של סמואלס, אז בת 32 בלבד, התנוסס כעבור כמה שבועות בראש רשימת המחברים של מאמר בכתב־העת Science, פסגת החלומות של כל חוקר צעיר. במהדורות החדשות כאן אצלנו מיהרו לראיין את "החוקרת הישראלית שחיה באמריקה", והתעניינו מתי היא חוזרת לארץ.

עם זיהוי המוטציה, בא לעולם תחום מחקרי חדש. עשרות חוקרים מאוניברסיטאות ומחברות תרופות גילו עניין בתגלית, ולא בכדי. לגן המדובר ישנו תפקיד משמעותי בארגון התאים בגוף, וברגע שמתחוללות בו מוטציות, הפועל שלו – האנזים שהוא מייצר – מתחיל להשתולל. התא מתחלק ללא הרף, יוצר גידולים, ולא ניתן להשתלט עליו. סמואלס מצאה שתי נקודות מסוימות בגן, "hotspots" שבהן מתרחשים כשמונים אחוזים מהמוטציות. בעקבות זאת החלו חוקרים בכל העולם לחפש כלים שיעכבו באופן כימי את הפועל החרוץ מדי, ולנסות לפתח שיטות לאבחון סרטן בצורה ממוקדת יותר ולא פולשנית. היום, בבדיקת דם פשוטה ניתן לזהות את קיומה של המוטציה בגן.
"גילוי המוטציה באמת יצר בום", אומרת סמואלס. "מאז ועד היום נערכים כנסים שלמים שמוקדשים רק לגן הזה, וכל חברת תרופות שמכבדת את עצמה מנסה לפתח טיפול למוטנט – כלומר למצוא מעכב לפעילות האנזים שלו ולהרגיע אותו. לפני כשנתיים האף־די־איי נתן אישור למעכב כזה, וכיום הוא נמצא בשימוש קליני לטיפול בחולות סרטן השד. מבחינתי זו סגירת מעגל אמיתית: התחלתי עם מדע בסיסי לגמרי, והיום הוא כבר משמש לאבחון וריפוי".
לא כל חוקר זוכה לראות את התגלית שלו מתורגמת לכלל פיתוח מעשי, בטח לא בשנות הארבעים לחייו. אבל אצל סמואלס (49), נשואה ואם לשניים, נדמה שהכול רץ. ב־17 השנים שחלפו מאז ההום־ראן ההוא בבולטימור, היא צברה כמות גדולה מאוד של הישגים נוספים והפכה לחוקרת סרטן בינלאומית. הבינלאומיות, אגב, באה מהבית. כבר כילדה בילתה סמואלס את רוב שנותיה בחו"ל: אביה, יליד אנגליה, מילא תפקידים בליגה נגד השמצה ושימש כמנהל מכון ויזנטל; אמה, ילידת ארגנטינה, הייתה ממקימות ארגון הדסה הבינלאומי ודיפלומטית באונסק"ו. הודות למגורים במקסיקו ובפריז, פרופ' סמואלס דוברת כיום ארבע שפות. "נחשפתי להמון תרבויות ואני מסוגלת להסתדר בכל מקום כמעט, אבל בשביל הילדים שלי בחרתי להתיישב במקום אחד. אנחנו גרים כאן במכון ויצמן ונהנים מאוד מהאווירה", היא אומרת, ומספרת על חיי חברה שוקקים בהשתתפות שכניה המדענים. ממשכנה בישראל היא הפכה לאחרונה לחברה באקדמיה האירופית לחקר הסרטן, זכתה בפרס אסטלה מדראנו לשנת 2020, נבחרה לגוף היוקרתי EMBO שמשרטט מדיניות בביולוגיה מולקולרית, ומונתה לעורכת בכתב־העת המדעי Cancer Discovery. בנוסף לכל אלה היא עומדת בראש שני מכוני דיאגנוסטיקה של הסרטן, ומנהלת בנק רקמות במרכז הבין־תחומי מורוס לחקר הסרטן במכון ויצמן.
אנחנו נפגשות בחדרה במחלקה לביולוגיה מולקולרית של התא. המעבדה שלה, שנמצאת לידנו, מתמקדת בגנטיקה של המלנומה – סרטן העור. המאמר האחרון שיצא מבין כותליה, ופורסם בסוף מרץ בכתב־העת Nature, עוסק במהפכה טיפולית שמשנה את חייהם של רבים: האימונותרפיה, גיוס מערכת החיסון של החולה עצמו לצורך מלחמה בסרטן. הרעיון האינטואיטיבי כל כך, ועם זאת קשה ליישום, התבשל במוחו של ד"ר סטיבן רוזנברג, חוקר יהודי־אמריקני שקיבל לפני כשבועיים את פרס דן דוד. רוזנברג הוא אמנם לא הראשון שחשב על רעיון האימונותרפיה, אבל הראשון שהצליח להציע טיפול אימונותרפי יעיל כנגד סרטן, במאמר חלוצי שפרסם בשנת 1985. אחרי שבמשך שנים טופלו חולי סרטן בשיטות הוותיקות של הקרנות, כימותרפיה וניתוחים, סלל רוזנברג דרך לעולם חדש של מאבק במחלה, ועל כך הוא מועמד לפרס נובל מזה כמה שנים. כיום הוא משמש ראש המחלקה לכירורגיה במכון הלאומי לסרטן שבבת'סדה, מרילנד, שם גם הצטלבה דרכה של סמואל עם זו שלו.
הצוות של סמואלס במרילנד היה הראשון שפרסם את הגנום השלם של המלנומה. "זו הייתה גאווה גדולה, בטח למעבדה של ארבעה אנשים. המטרה של כל זה היא רפואה מותאמת אישית: רופאים יוכלו לאפיין את הפרופיל הגנטי הייחודי של הסרטן שממנו סובל כל חולה, ולהתאים לו תרופות שחוסמות את הגורמים למחלה"
"כשסיימתי את הפוסט־דוקטורט במעבדה של ווגלשטיין, הבנתי שאני מוכנה לפתוח מעבדה משלי, והתחלתי להגיש בארץ ובארה"ב מועמדויות למשרה", חוזרת סמואלס אחורה בזמן. "הייתי כבר אמא לבן, אורי בעלי (ד"ר אורי לב, מומחה לביואתיקה, היום מרצה במכללת ספיר בנגב – י"א) היה עוד לפני הפוסט־דוקטורט, אז החלטנו להישאר בארה"ב. הוא בחר במכונים הלאומיים לבריאות (NIH), ואני פתחתי אצלם מעבדה. זה היה אחלה מקום ללכת אליו, כי אנשי המכונים הם אלה שהובילו את ריצוף הגנום האנושי וגם לקחו חלק בריצוף הגנום הסרטני – שזה בדיוק מה שרציתי לעשות במעבדה שלי".
 https://www.makorrishon.co.il/wp-conte ... es-1287482495-750x500.jpg 750w" sizes="(max-width: 1024px) 100vw, 1024px" />
https://www.makorrishon.co.il/wp-conte ... es-1287482495-750x500.jpg 750w" sizes="(max-width: 1024px) 100vw, 1024px" />מי שקיבל אותה למוסד היוקרתי היה פרנסיס קולינס, דמות מפתח בפרויקט הגנום האנושי ומי שעומד בראש NIH היום. הוא הציע לסמואלס משרה שהלמה את תוכניותיה, והתעניין אם יש לה מאגר תאים סרטניים לעבוד איתו; כדי למפות די־אן־איי, צריך להשיג דגימות מחולים. "השבתי שיש לי רקמות, אבל הן בישראל. הוא אמר 'דברי עם סטיבן רוזנברג, זה האיש שאת מחפשת'. נפגשתי עם רוזנברג, ואחרי רבע שעה היה ברור לשנינו שכדאי שנשתף פעולה – הוא אימונולוג, אני גנטיקאית וזה שילוב מצוין.
"אני כבר ידעתי בדיוק מה אני מתכננת: לא רציתי לעבוד רק עם גידולים, רציתי שיהיו לי תאים שאני יכולה לגדל בתרבית, ולא כל סוג סרטן אפשר לגדל בצורה כזו. רוזנברג ידע לקחת רקמה של גידול סרטני ולייצר ממנה תאים שגדלים באינקובטור. הוא עזר לי להקים את הבנק שלי, ותוך שלושה שבועות כבר היה לי מלאי תאים באינקובטורים, גידלתי אותם בעצמי והתחלנו לאפיין אותם גנטית. עד היום רוזנברג הוא אחד ממשתפי הפעולה הכי חשובים שלי".
למה בחרת לעסוק דווקא במלנומה? זה קשור לעובדה שישראל היא מדינה שטופת שמש, ויושבת במקום מכובד ברשימה העולמית של שכיחות המחלה?
"באמת בזמנו היינו מקום שלישי בעולם בשיעור מקרי המלנומה; עכשיו אנחנו כבר לא שם, למזלנו. כשמקימים מעבדה כדאי להתמקד בסוג סרטן מסוים, כי סרטן הוא למעשה מצבור של מאות מחלות שונות, ואתה צריך לבחור אחת מהן כדי להבין אותה לעומק. אני בחרתי במלנומה, קודם כול כי הבנת הגנטיקה שלה לקתה בחסר. בנוסף לכך זוהי מחלה שתוקפת בגילים צעירים, היא אגרסיבית וקטלנית מאוד, ולא היו לה תרופות יעילות. מלנומה בשלב מתקדם נחשבה לגזר דין מוות.
"ברגע שנכנסתי לתחום, גיליתי דבר חשוב מאוד על מלנומה: המוטציות שמתרחשות בגנים קורות שוב ושוב ושוב, כי אתה נחשף לקרני UV (אולטרה־סגול) בלי הפסקה. זה דבר שלא היה ידוע. ריצפתי גנום שנלקח מחולי סרטן העור, ולא משנה לאן הסתכלתי – מצאתי מוטציות. זה הדהים אותי. אחרי שפרסמתי את הנתונים, תקפו אותי בכנסים. אמרו לי: 'מה, בכל מקום שאת מחפשת יש מוטציות? זה לא ייתכן'. אמרתי להם שזה מה שאני מוצאת, והתוצאות לא משקרות. לפני שהיו לנו טכנולוגיות הריצוף שיש לנו היום, לא ראינו את ריבוי המוטציות; ברגע שקיבלנו כלים, פתאום הבנו שבמלנומה יש פי עשרה יותר מוטציות מבכל סוג סרטן אחר – חוץ מסרטן הריאות, שקשור גם הוא בחשיפה מתמדת, במקרה שלו לעישון".
"במחקר המדעי אנחנו במקום גבוה מאוד, אבל קשה לעשות בארץ עבודה שאפשר לתרגם לשימוש קליני. רוב הרקמות שאני מקבלת הן מחו"ל, וזה הזוי – הרי לא חסרים בארץ חולי סרטן, לצערי. הדגש כאן הוא בעיקר על היי־טק, ולא מספיק על ביו־טק. זה חבל, כי יש כאן כישרונות מעולים"
לא כל מוטציה בתא גורמת לסרטן, ולפעמים אין לה בכלל השפעה. אם אצל חולי מלנומה יש מאות מוטציות, איך יודעים לאתר בדיוק את זאת שעושה צרות?
"ניתן לעשות חישובים סטטיסטיים, לבנות מודלים ולגלות לאיזו מוטציה יש תפקיד בתהליך הסרטני, אבל בסופו של דבר צריך לבדוק את פעילות הגן המוטנט בניסויים 'רטובים' במעבדה. משבטים אותו ובודקים את הפעילות הביוכימית והביולוגית שלו בתאים, לעומת המצב כשאין מוטציה. מה שיפה בסרטן הוא שתא כזה מדגים אבולוציה בצורה מדויקת: אם שינוי מסוים בדי־אן־איי גורם לתא לגדול יותר או להיות חסין יותר, יהיו יותר תאים כאלה. למה הדבר דומה? למי שיש לו גנים 'חזקים' יותר, ולכן יהיו לו יותר ילדים, ואבולוציונית הגנים שלו יופיעו באחוז גבוה יותר באוכלוסייה. לכן אני כל כך אוהבת גנטיקה של הסרטן, כי כשאת עושה את זה נכון, התוצאות לא משקרות".
סמואלס התחילה לרצף גנים יחידים, אחר כך משפחות, ובינתיים הטכנולוגיה התפתחה והשתכללה ואפשרה לה לעשות ריצוף של כל הגנום בו זמנית. אחת העבודות המשותפות שלה עם רוזנברג הביאה לזיהוי מוטציה גנטית נוספת, שסמואלס מגדירה אותה "עקב אכילס של חלק נכבד ממקרי המלנומה". המוטציה הזו, שמתחוללת בגן ERBB4, כבר היוותה באותם ימים מטרה לתרופה המשמשת לטיפול בסרטן השד. מחקרים שבדקו אם התרופה תועיל גם לחולי מלנומה, הראו תוצאות חיוביות.
 https://www.makorrishon.co.il/wp-conte ... ock_670583950-750x500.jpg 750w" sizes="(max-width: 1024px) 100vw, 1024px" />
https://www.makorrishon.co.il/wp-conte ... ock_670583950-750x500.jpg 750w" sizes="(max-width: 1024px) 100vw, 1024px" />בשש שנות פעילותה במרילנד השיגה סמואלס גם את הגביע הקדוש של חקר המלנומה: אחרי עבודה מאומצת, ותוך מירוץ צמוד מול מעבדות מייל ומהרווארד, הצוות שלה היה הראשון שפרסם את הגנום השלם של המחלה. "זו הייתה גאווה גדולה, בטח למעבדה של ארבעה אנשים. היתרון שלנו היה שתמיד חשבנו מחוץ לקופסה – איך אנחנו עובדים יותר חכם".
מהי המשמעות המעשית של מיפוי מחלה?
"המטרה של כל זה היא רפואה מותאמת אישית: רופאים יוכלו לאפיין את הפרופיל הגנטי הייחודי של הסרטן שממנו סובל כל חולה, וכך להתאים לו טיפול באמצעות שילוב של תרופות שחוסמות באופן פרטני ומדויק את הגורמים למחלה".
פעם בשנה הייתה מגיעה אליה למרילנד לביקור אורחת מישראל, שתמיד התעניינה מתי סמואלס חוזרת ארצה. הייתה זו פרופ' ורדה רוטר ממכון ויצמן, מחלוצי חקר הגן p53, יחד עם עמיתה פרופ' משה אורן. הקשר של סמואלס עם המכון נשמר הודות לסמינרים שהעבירה בו בכל פעם שנחתה בישראל. בינתיים נולד בנה השני, בן זוגה סיים את הפוסט־דוקטורט, והמשפחה שבה ארצה. "לפני שמונה שנים התמקמתי במכון ויצמן, והחלטתי לעבוד על התחום של אינטראקציה בין הסרטן למערכת החיסונית", מספרת סמואלס. "בשנים האחרונות פרסמנו כמה וכמה מאמרים שעוסקים באימונותרפיה, והם זכו לחשיפה גדולה מאוד".
אימונותרפיה היא כאמור שיטת טיפול שרותמת את המערכת החיסונית למלחמה בסרטן. לשם כך היא נעזרת ב"תאי T", שנמצאים בתוך תאי הדם הלבנים. כל תא T מצויד בקולטן (Receptor) – מעין סורק או גלאי משוכלל. כמו מאבטח אחראי הוא מסתובב וסורק את התאים בסביבתו, וברגע שהוא מזהה "ברקוד" בעייתי המעיד על איום או מוטציה מסוכנת, הוא הופך אקטיבי ומחסל את התא הנגוע. גם את התאים הסרטניים יכולים תאי T לזהות, ולהבחין בינם לבין תא נורמלי. לפעמים הם נכשלים במלאכתם, וכך מצליח תא סרטני להשתכפל. ברפואה לפיכך מתייחסים לא פעם לסרטן ככשל חיסוני.
רוזנברג החליט לנסות לתת דחיפה לתאי T שחדלו ממלאכתם. "הוא לוקח תאים כאלה מתוך הגידול של החולה, שם אותם בצלחת, מקנה להם תנאים נוחים ומאקטב אותם מחדש – כלומר מגביר את פעילותם ומרבה אותם. אחר כך הוא מזריק אותם בחזרה לחולה. אנשים לא האמינו שהוא יצליח. ניסו לעשות את זה עשרות שנים לפניו ובמקביל אליו, לשווא. אבל רוזנברג הצליח לקבל תגובה לטיפול אצל כחמישים אחוזים מהחולים".
אלא שלא תמיד ניתן להוציא תאי T מחולים ולרבות אותם במעבדה, והשיטה גם לא מתאימה לכל סוג של סרטן. כאן נכנס לתמונה פרופ' זליג אשחר ממכון ויצמן, גם הוא חתן טרי של פרס דן דוד. אשחר ערך מחקר חלוצי שביקש לעבוד בשיטה חדשה: להקנות לתאים האלה, באמצעות הנדסה גנטית, "משקפיים" משוכללים לזיהוי התאים הסרטניים. רוזנברג, שפגש את אשחר בארה"ב, שכנע אותו להישאר ב־NIH לשבתון ומאותו רגע הם התחילו להשתמש בשיטה בניסויים קליניים – בהתחלה בעכברי מעבדה ואחר כך בחולים שסבלו מסרטן הדם ונחשבו חשוכי מרפא. התוצאות הדהימו את העולם.
כדי להמחיש לי איך עובדת השיטה, שולפת סמואלס טוש מחיק, ולפתע שולחן הזכוכית העגול שבחדרה הופך ללוח. היא מציירת עליו את התאים, מסמנת מהלכים, נוקטת בשמות המולקולות המעורבות, והשולחן מתמלא באותיות לועזיות, חיצים, צבעים ואיורי פפטידים. אני מבקשת ממנה שתסביר לי מה גורם לתאי T להתעייף פתאום, הרי הם מתוכנתים להרוג. "הסרטן הוא חכם, והוא יודע לעכב את התא, לגרום לו להתעייף. הוא יוצר עם תאי T אינטראקציה שמונעת מהם לפעול, כך שהם לא יכולים יותר להרוג. אבל כאן מגיעה אחת המהפכות של האימונותרפיה: הזרקת נוגדנים שמעכבים את האינטראקציה הזאת. מה שקורה הוא שתא T שהכיר את המטרה שלו, מקבל שוב אפשרות לבצע את תפקידו ולהרוג. השיטה גרפה פרס נובל בשנת 2018, וכבר הפכה לתרופה שמשמשת בסל הבריאות לטיפול בחלק מסוגי הסרטן".
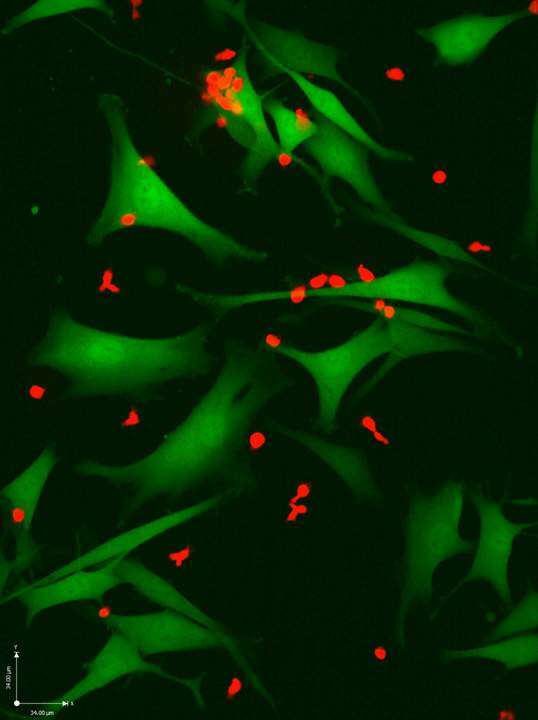
עיון במאמרים שיצאו מכאן מראה שסמואלס ועמיתיה מקדישים המון תשומת לב ל"תמרורי האזהרה" – מקטעי חלבון שמוצגים על פני התא, ומסמנים לתאי המערכת החיסונית: תא סרטני לפניך. במחקר האחרון דובר אפילו על חיידקים ממערכת העיכול שייקראו לדגל ויאותתו על קיומו של תא סרטני. "זה השלב הבא", אומרת סמואלס. "אנחנו יודעים שישנם וירוסים שנכנסים לתוך התא ויכולים לשמש תמרורי אזהרה. במאמר שעוסק בקורונה, בלי קשר לסרטן, הראינו שווירוס נכנס לתוך תאים ומוצג עליהם. הרבה לפנינו הוכיחו שחיידקים במערכת העיכול יכולים להגיע לגידולים, אבל אף אחד לא הוכיח שהם מוצגים לראווה על גבי תאים סרטניים. אנחנו הראינו שהחיידקים יכולים להיכנס לתאים של המלנומה, ואפשר לנצל את זה גם ברמה תרפויטית. הם יכולים להיות מוצגים על התא, והם יכולים לאקטב – לתת דחיפה למערכת החיסונית. זה סיפור טרי מאוד, ויש לו חשיבות פרקטית נוספת: אף אחד לא הבין למה ה'מעכבים' עובדים טוב יותר אצל חולים שיש להם אוכלוסיית חיידקים מסוימת במעי, ויכול להיות שזה קצה חוט להבנת הקשר בין השניים. יש לפנינו כמובן עוד הרבה עבודה, אבל המאמר הזה הוא סופר־חשוב".
המהפכה כבר כאן, אבל שיעורי ההצלחה עדיין נמוכים – בין שישים לשבעים אחוזים מחולי המלנומה לא מגיבים לאימונותרפיה. למה זה קורה? מה גורם לה לעבוד אצל אנשים מסוימים ולהיכשל אצל אחרים?
"התמונה לצערנו עדיין לא ברורה. תראי, לאינדיקטור שמצביע על יעילות הטיפול אנחנו קוראים ביו־מרקר. ככל שיש לך ביו־מרקר טוב יותר, את תדעי למי לתת את הטיפול ולמי לא. למשל, התרופה שפותחה בעקבות המוטציה שגיליתי במעבדה של ברט, תינתן מן הסתם לחולים שהמוטציה הזו קיימת אצלם. באימונותרפיה הביו־מרקרים עדיין לא ברורים לגמרי, וממחקר למחקר אנחנו למדים עוד. הקורלציה שכן מוצאים בתחום היא בין מספר המוטציות בגידול לבין השפעת הטיפול. זה הגיוני: ככל שיש יותר מוטציות – יש יותר תמרורי אזהרה, וכך גדל הסיכוי שתאי T יגיבו ויצאו למלחמה. ועם זאת אנחנו רואים גם חולים שיש להם מספר מוטציות נמוך, ובכל זאת הם מגיבים לטיפול".
 https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-1232x1536.jpg 1232w, https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-1643x2048.jpg 1643w, https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-750x935.jpg 750w, https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-1140x1421.jpg 1140w" sizes="(max-width: 2054px) 100vw, 2054px" />
https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-1232x1536.jpg 1232w, https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-1643x2048.jpg 1643w, https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-750x935.jpg 750w, https://www.makorrishon.co.il/wp-content/uploads/2021/05/קרדיט-רודה-באר-באדיבות-המכון-הלאומי-הסרטן-1140x1421.jpg 1140w" sizes="(max-width: 2054px) 100vw, 2054px" />איך אפשר להסביר את זה?
"במאמר שפרסמנו בשנת 2019, ואני מאוד גאה בו, הצבענו על ביו־מרקר נוסף: רמת ההטרוגניות הגנטית של הגידול. ככל שההטרוגניות גדולה יותר, כך הטיפול האימונותרפי יעיל פחות, כיוון שיש כאן אפקט מדלל. אני אסביר: אם יש גידול שעשוי מהמון תאים וכולם דומים ברמה הגנטית, הם כולם מציגים אותם פפטידים – אותו 'ברקוד' שתאי המערכת החיסונית מזהים. אבל אם יש לך תאים בעלי מוטציות כאלה ותאים עם מוטציות אחרות, וכל אחד מציג פפטידים שונים, המערכת החיסונית לא יכולה להתמודד עם השפע הזה, היא מוצפת. ראינו את זה גם בעכברים וגם בחולים אנושיים. זה ביו־מרקר שניתן לחשב אותו ולומר – אם למישהו יש הטרוגניות כזו, לא כדאי לתת את הטיפול המסוים. כדאי לתת אותו בשלב יותר מוקדם, כשההטרוגניות נמוכה יותר.
"ואם לחזור לשאלתך – שלושים־ארבעים אחוזים שמגיבים לטיפול הם לא מעט. מלנומה היא מחלה שמתים ממנה, ועד לפני עשור לא היה לה שום טיפול; לכל היותר יכולנו להאריך חיים בשלושה חודשים. יש עוד הרבה ביו־מרקרים אחרים שנחקרים, וכנראה תהיה אינטגרציה של כולם, בדרך להבין למי כדאי להעניק את הטיפול האימונותרפי".
"אני לא יכולה להגיד שנעלים את הסרטן. דיאגנוסטיקה מוקדמת היא עדיין הדבר הכי טוב שיש, ויש לנו כלים שמאפשרים לעקוב בצורה טובה יותר אחרי הסרטן ואחרי המוטציות. אני חושבת שנוכל להפוך את הסרטן למחלה כרונית שאפשר לחיות איתה, וזו תהיה התקדמות גדולה מאוד"
במירוץ לריפוי הסרטן, איפה נמצא המחקר הישראלי ביחס למדינות אחרות בעולם?
"במחקר המדעי בכלל אנחנו במקום גבוה מאוד. מכון ויצמן דורג לפני כמה שנים בעשירייה הראשונה מבחינת מחקר בינלאומי, מיד אחרי המכונים שבארצות הברית. גם ספציפית בחקר הסרטן אנחנו במקום מצוין. מה שקשה לעשות בארץ זו עבודה שאפשר לתרגם לשימוש קליני, ובתור מישהי שצריכה שיתופי פעולה ודגימות מחולים, זה לא קל. רוב הרקמות שאני מקבלת הן מחו"ל, וזה הזוי – הרי לא חסרים לנו בארץ חולי סרטן, לצערי. אני מנסה לפתח שיתופי פעולה, גם רופאים רוצים מאוד את העבודה המשותפת, אבל אין להם מספיק זמן לעסוק גם במחקר והמערך פה לא מספיק מאורגן. צריך אנשים שיאספו דגימות ויקטלגו אותן, וצריך טכנולוגיה מתאימה.
"לתחושתי הדגש בארץ הוא בעיקר על היי־טק, ולא מספיק על ביו־טק. זה חבל, כי יש כאן כישרונות מעולים ורעיונות טובים מאוד, אבל אין מספיק ניצול של הידע הזה לתעשייה. לאחרונה הצטרפתי לארגון בשם 8400, שהוקם לפני ארבע שנים כדי לחבר בין רופאים למדענים וליצור גשר בין רעיונות ואקדמיה לבין רפואה ותעשייה. השנה ייפגשו במסגרת הזו לראשונה נציגים של משרדי ממשלה ואנשי מדע, כדי לחשוב ביחד איך אפשר לשפר את המצב בארץ בתחום הזה. כי הפוטנציאל הוא אדיר, והביו־טק יכול לעוף".
 https://www.makorrishon.co.il/wp-conte ... _202113_41_04-750x519.jpg 750w" sizes="(max-width: 1024px) 100vw, 1024px" />
https://www.makorrishon.co.il/wp-conte ... _202113_41_04-750x519.jpg 750w" sizes="(max-width: 1024px) 100vw, 1024px" />לסיום אני שואלת את סמואלס אם יבוא יום וננצח את הסרטן, על אף שכאמור מדובר במאות מחלות. "זו לא מחלה שאני יכולה להגיד שנפתור אותה", היא משיבה. "דיאגנוסטיקה מוקדמת היא עדיין הדבר הכי טוב שיש היום, ומתבצעת הרבה עבודה בתחום הזה. יש לנו כלים שאנחנו יכולים בעזרתם לעקוב בצורה טובה יותר אחרי הסרטן ואחרי המוטציות. יש כאמור מוטציות שאפשר לעכב, ובמקומות מסוימים כבר עושים את זה. באנגליה למשל אחיות מגיעות לבית של החולה ולוקחות ממנו דם, במעבדה בודקים אילו מוטציות יש בגנים שלו, ועל פי זה מותאם לו טיפול.
"אני חושבת שנוכל להפוך את הסרטן למחלה כרונית שאפשר לחיות איתה, וזו כמובן תהיה התקדמות גדולה מאוד. במלנומה, כמו שאמרתי, לא היו בעבר אופציות להחלמה, והיום חולים נרפאים. את הנוגדנים אמנם צריך לקבל לאורך זמן, אבל יש חולים שבמשך שנים המחלה לא חזרה לגופם. זה משהו שפעם לא היינו רואים בסרטן אגרסיבי. צריך אמנם לחשוב על רפואה מותאמת אישית, ועם זאת אפשר למצוא את הדברים שמשותפים לחולים השונים, כדי שתהיה תרופה על המדף ולא נייצר תרופה לכל אדם. עשינו כברת דרך אדירה, ואני אופטימית מאוד".
לתגובות: dyokan@makorrishon.co.il
The post העור בקצה המנהרה: מגזר דין מוות למחלה כרונית appeared first on מקור ראשון.
| השולח | דיון |
|---|
